Медь на воздухе покрывается тонким слоем оксида
|
Упражнение: 1 Медь на воздухе покрывается тонким слоем оксида, придающим ей темную окраску, но во влажном воздухе и в присутствии углекислого газа на ее поверхности образуются соединения зеленого цвета ((CuOH)2CO3). Напишите уравнения реакции коррозии меди.
2Cu + O2 = 2CuO |
Упражнение: 2 Щелочные и щелочноземельные металлы хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха. Напишите уравнения возможных реакций, сопровождающих коррозию металлов.
6Li + 3N2 = 2Li3N |
Упражнение: 3 Что такое ингибиторы коррозии? Что такое протекторы? Чем отличается механизм их действия при защите металлов от коррозии? Ингибторы коррозии – это вещества, которые в десятки и сотни раз уменьшают агрессивность среды. Применяют в замкнутых агрессивных средах, например трубопроводах для предотвращения коррозии изнутри. |
Упражнение: 4 Луженое железо (покрытое защитной оловянной пленкой) поцарапали. Что будет происходить с изделием? По таблице: "электрохимический ряд напряжений металлов", железо находится левее олова и следовательно активность Fe > Sn, поэтому в паре металлов: Fe + Sn, железное изделие будет интенсивно разрушаться в месте царапины. Упражнение: 5 О каком материале строка В.В.Маяковского: «По крыше выложили жесть…»? Жесть это луженое железо, т.е. железный лист покрытый слоем олова. |
Упражнение: 6 В начале XXв. Из нью-йоркского порта вышла в открытый океан красавица яхта. Её владелец, американский миллионер, не пожалел денег, чтобы удивить свет. Корпус яхты был сделан из очень дорогого в то время алюминия, листы, которого скреплялись медными заклепками. Это было красиво – сверкающий серебристым блеском корабль, усеянный золотистыми головками заклепок! Однако через несколько дней обшивка корпуса начала расходиться и яхта быстро пошла ко дну. Почему? |
к упражнению 6 отв.
В месте контакта меди и алюминия в водной среде образовалась электронная пара. Al – эначительно левее (активнее) меди в э/х ряду напряжений, следовательно, алюминий стремительно начал разрушаться: |
§ 13. Коррозия металлов -
1. Медь на воздухе покрывается тонким слоем оксида, придающим ей темную окраску, но во влажном воздухе и в присутствии углекислого газа на ее поверхности образуются соединения зеленого цвета ((CuOH)2СO3). Напишите уравнения реакций коррозии меди.2. Щелочные и щелочноземельные металлы хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха. Напишите уравнения возможных реакций, сопровождающих коррозию этих металлов.
3. Что такое ингибиторы коррозии? Что такое протекторы? Чем отличается механизм их действия при защите металлов от коррозии?
Ингибиторы коррозии — вещества, которые вводят в рабочую среду, где находятся металлические детали для уменьшения агрессивности среды.
Протекторы — металлы, более активные по своей химической природе, нежели тот, из которого выполнено защищаемое изделие.
Различия между этими способами защиты заключается в том, что в 1-м случае просто уменьшается скорость коррозии, а во 2-м — коррозированию подвергается другой материал.
4. Луженое железо (покрытое защитной оловянной пленкой) поцарапали. Что будет происходить с изделием?
Изделие из луженого железа в случае нарушения защитной пленки будет более подвержено коррозии, т. е. этот процесс ускорится.
5. О каком материале строка В. В. Маяковского: «По крыше выложили жесть...» ?
В.В. Маяковский говорит об оцинкованном железе.
6. В начале XX в. из нью-йоркского порта вышла в открытый океан красавица яхта. Ее владелец, американский миллионер, не пожалел денег, чтобы удивить свет. Корпус яхты был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклепками. Это было красиво — сверкающий серебристым блеском корабль, усеянный золотистыми головками заклепок! Однако через несколько дней обшивка корпуса начала расходиться и яхта быстро пошла ко дну. Почему?
Думаю, всем хорошо известно, что такое гальванический элемент. Два соединенных между собой электрода опускают в раствор электролита, на одном электроде в результате ОВР происходит осаждение металла, на другом, наоборот, растворение. Также получилось и с кораблем: морская вода сыграла роль раствора электролита. Алюминиевый корпус и медные заклепки — роль электродов в результате металлический Al переходит в Al3+, на медном корпусе выделяется водород.
Прошу о помощи, о великий народ людской! 1) медь на воздухе покрывается тонким слоем оксида, придающим ей темную окраску, но во влажном воздухе и в присутствии углекислого газа на ее поверхности образуются соединения зеленого цветва ((cuoh)2 co3). напишите уравнения реакций коррозии меди. 2) щелочные и щелочноземельные металлы хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха. напишите уравнения возможных реакций, сопровождающих коррозию этих металлов. — Знания.site
Прошу о помощи, о великий народ людской! 1) медь на воздухе покрывается тонким слоем оксида, придающим ей темную окраску, но во влажном воздухе и в присутствии углекислого газа на ее поверхности образуются соединения зеленого цветва ((cuoh)2 co3). напишите уравнения реакций коррозии меди. 2) щелочные и щелочноземельные металлы хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха. напишите уравнения возможных реакций, сопровождающих коррозию этих металлов. — Знания.site| Тема: Металлы (Коррозия металлов) Условие задачи полностью выглядит так:
Задача из главы Металлы по предмету Химия из задачника Химия 9, Габриелян (9 класс) Если к данной задачи нет решения - не переживайте. Наши администраторы стараются дополнять сайт решениями для тех задач и упражнения где это требуется и которые не даны в решебниках и сборниках с ГДЗ. Попробуйте зайти позже. Вероятно, вы найдете то, что искали :) |
Коррозия меди | Химик.ПРО – решение задач по химии бесплатно
Как протекает коррозия меди в атмосферных условиях? Чем вызвано образование зеленого налета на медных изделиях после длительного пребывания на воздухе? Чем можно объяснить преобразование зеленого в черный налет после нагревания меди?
Решение задачи
Рассмотрим, как протекает коррозия меди в атмосферных условиях.
В зависимости от состава среды и еще многих факторов на медной поверхности в атмосфере сначала образуется очень тонкая защитная пленка, состоящая с оксидов меди и ее чистой закиси. Время образования этой пленки может достигать нескольких лет. Поверхность немного темнеет, становится коричневатой. Иногда пленка может быть почти черного цвета (во многом зависит от состава коррозионной среды). После образования оксидного слоя на поверхности начинают скапливаться соли меди, имеющие зеленоватый оттенок. Коррозия меди
Образующийся оксид меди и соли называют еще патиной. Цвет патины колеблется от светло-коричневого, до черного и зеленого. Цвет патины зависит от качества обработки поверхности, состава самого металла и среды, времени контакта с коррозионной средой (от внутренних и внешних факторов). Коррозия меди. Закись меди – красно-коричневого цвета, окись – черного. Голубые, зеленые, синие и другие оттенки патины обуславливаются различными медными минералами (сульфаты, карбонаты, хлориды и др.). Патина по отношению к основному металлу нейтральна, т.е. не оказывает на медь вредного влияния (кроме хлористой меди). Соли и оксиды, формирующие патину, нерастворимы в воде и обладают естественными декоративными, защитными свойствами по отношению к поверхности меди. Коррозия меди
В атмосферных условиях, под действием кислорода медь окисляется, в результате чего образуется оксид меди (I) (закись меди):
Цвет этого соединения коричнево-красный.
При дальнейшей оксидации образуется чёрный оксид меди (II):
Cu0 + O20 = 2CuO
Коррозия меди. Электроны двигаются от меди к кислороду.
Вывод: происходит окисление меди и на поверхности изделия образуется оксидная пленка.
Эти соединения защищают металл, но лишь в том случае, если оксидная плёнка не повреждена другими включениями. При этом оксид меди (II) является наиболее устойчивым.
Влажность и углекислый газ после длительного пребывания на воздухе вызывают образование зеленого налета на медных изделиях – карбаната меди и гидрооксида меди (смесь их называется малахитом):
2Cu + H2O + CO2 + O2 → CuCO3 ⋅ Cu(OH)2.
После нагревания меди преобразование зеленого в черный налет обусловлено разложением малахита (зеленый) и получением оксида меди (II) (черный):
Коррозия меди
Прошу о помощи, о великий народ людской! 1) медь на воздухе покрывается тонким слоем оксида, придающим ей темную окраску, но во влажном воздухе и в присутствии углекислого газа на ее поверхности образуются соединения зеленого цветва ((cuoh)2 co3). напишите уравнения реакций коррозии меди. 2) щелочные и щелочноземельные металлы хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха. напишите уравнения возможных реакций, сопровождающих коррозию этих металлов. — Знания.online
ПРОШУ О ПОМОЩИ, О ВЕЛИКИЙ НАРОД ЛЮДСКОЙ!
1) Медь на воздухе покрывается тонким слоем оксида, придающим ей темную окраску, но во влажном воздухе и в присутствии углекислого газа на ее поверхности образуются соединения зеленого цветва ((CuOH)2 CO3). Напишите уравнения реакций коррозии меди.
2) Щелочные и щелочноземельные металлы хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха. Напишите уравнения возможных реакций, сопровождающих коррозию этих металлов.
Синтез высоко ориентированных нанопроволок оксида меди путем нагрева медной фольги
Мы исследовали влияние размера зерен и ориентации медных подложек на рост нанопроволок оксида меди методом термического окисления. Длинные, менее шероховатые, высокоплотные и ориентированные нанопроволоки оксида меди были синтезированы путем нагрева ориентированной (200) медной фольги с малым размером зерна в газообразном воздухе. Длинные и выровненные нанопроволоки диаметром около 80 нм могут быть сформированы только в коротком диапазоне температур от 400 до 700 ° C.С другой стороны, однородные, гладкие и ориентированные нанопроволоки не образуются в случае большего размера кристаллитов медных фольг с ориентацией (111) и (200). Меньший размер зерен медной фольги с ориентацией (200) благоприятен для роста высоко ориентированных, гладких поверхностей и нанопроволок большего диаметра методом термического окисления.
1. Введение
Наноструктурированные материалы привлекли большое внимание ученых из-за их интересных химических и физических свойств, зависящих от размера, и потенциальных технологических применений.Одномерные (1D) наноструктуры, такие как нанопроволоки, наноленты, наностержни и нанотрубки, стали предметом интенсивных исследований в результате их уникальных свойств и потенциальных возможностей использования [1]. Нанопроволоки и наностержни из различных полупроводниковых материалов, включая Si, Ge, GaN, ZnO и т. Д., В последние годы были в центре внимания интенсивных исследований. Для изготовления одномерных наноструктур полупроводниковых материалов использовались различные подходы, такие как пар-жидкость-твердое тело [2], пар-твердое тело [1] и методы роста, опосредованные темплатами [3].
Оксид меди (CuO) с известной шириной запрещенной зоны 1,2 эВ имеет интересную моноклинную кристаллическую структуру, принадлежащую к классу изоляторов Мотта, электронная структура которых не может быть описана традиционной зонной теорией [4]. Возрастает интерес к разработке одномерных наноструктур CuO для таких устройств, как газовые сенсоры [5, 6], магнитные носители информации [7], катализаторы [8–10] и полевые эмиттеры [11]. В течение последних двух лет одномерные нанопроволоки, наностержни, нановискеры и нанолисты CuO были синтезированы различными методами роста, такими как термическое разложение прекурсоров CuC 2 O 4 [12], гидротермальное разложение [13], самокаталитические процессы роста [14] и т. д.Важными факторами при синтезе одномерной наноструктуры являются контроль состава, размера и кристалличности. Более того, с точки зрения изучения фундаментальных свойств нанопроволок, а также их применения, метод приготовления одномерных наноструктур должен быть простым для производства больших количеств и поддающимся контролю диаметра и длины. По сравнению со сложными химическими методами термический отжиг или термическое окисление медной фольги является простым, удобным и быстрым методом синтеза нанопроволок CuO.Этот метод становится все более привлекательным методом синтеза наноструктур. К настоящему времени опубликовано множество исследований по синтезу нанопроволок CuO термическим отжигом медных фольг в кислородной атмосфере [15–26]. Однако недавние исследования нанопроволок CuO были сосредоточены на влиянии времени роста, температуры и окислительной среды на скорость роста, распределение по размерам и реальную плотность нанопроволок CuO [11, 22]. Было показано, что время роста можно использовать для управления распределением длины нанопроволоки [11], температуру роста можно использовать для управления распределением диаметра нанопроволоки, а парциальные давления O 2 и H 2 O сильно влияют на площадь поверхности. плотность нанопроволок [22].Также было показано, что состояние поверхности медной подложки существенно влияет на рост нанопроволок [14,16]. Но о росте длинных, высокоплотных и ориентированных нанопроволок оксида меди редко сообщалось в литературе. Это связано с тем, что влияние медных подложек на структуру нанопроволок оксида меди до сих пор не изучено. Согласно предыдущим исследованиям, кажется очень трудным вырастить однородные и ориентированные вертикальные нанопроволоки оксида меди из тонких пленок чистого металла только путем термического окисления, и было опубликовано очень мало подходов к этому вопросу.В этом исследовании мы сообщаем о простом процессе выращивания высокоплотных, однородных и вертикально ориентированных нанопроволок оксида меди путем термического окисления. Мы исследовали влияние размера зерна, ориентации зерен и шероховатости поверхности подложек на рост нанопроволок оксида меди.
2. Методика эксперимента
Чтобы исследовать влияние размера зерен и ориентации медных подложек на формирование нанопроволок оксида меди во время термического окисления, четыре медные фольги (приобретены у Nilaco Co.Ltd.). Фольги были нарезаны на стандартные размеры 1 см × 1 см. Подложки промывали разбавленной соляной кислотой для удаления слоя естественного оксида и адсорбированных примесей с последующей очисткой ацетоном, метанолом и деионизированной водой под ультразвуковой ванной в течение 5 мин и, наконец, сушили потоком N 2 . Очищенные образцы помещали в кварцевую лодочку. Кварцевую лодочку устанавливали в центре кварцевой трубки, а кварцевую трубку устанавливали в середине горизонтальной трубчатой печи.Влажность окружающего воздуха нестабильна; это может повлиять на рост нанопроволок, поэтому мы используем воздух в цилиндре стабильности. Воздух из баллона сначала вводили в кварцевую трубку со скоростью 1 л / мин в течение 20 минут для удаления окружающего воздуха из системы, а затем доводили до 0,5 л / мин для окисления медной фольги. Трубчатую печь нагревали до заданной температуры (300, 400, 500 и 600 ° C при атмосферном давлении). После достижения заданной температуры подачу газообразного воздуха прекращали и использовали поток газа N 2 со скоростью 1 л / мин.Пленке давали возможность естественным образом остыть до комнатной температуры, чтобы предотвратить растрескивание тонкой пленки из-за термического напряжения и дальнейшего окисления атмосферным воздухом (возникающего из-за быстрого охлаждения). Подложка была извлечена из печи для дальнейшего анализа.
Кристаллическая структура и фазовый состав были идентифицированы методом рентгеновской дифракции (XRD, Rigaku RINT-2100) с использованием рентгеновского излучения Cu-K α 40 кВ, 30 мА. Шаг сканирования 0,02 ° применяли для записи рентгенограмм в диапазоне 2 θ градусов 40–55 °.Морфология нанопроволок CuO была охарактеризована с помощью сканирующего электронного микроскопа (SEM, Hitachi S-3000H), работающего при 15 кВ. Просвечивающая электронная микроскопия (ПЭМ) и электронографическое наблюдение выполнялись с использованием JEOL JEM-4000 EXII.
3. Результаты
3.1. Влияние размера кристаллитов
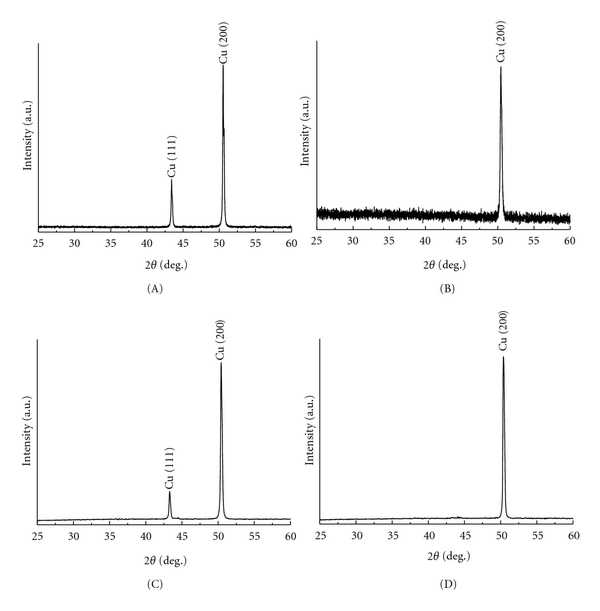
Чтобы узнать кристаллическую структуру и соответствующий размер зерна медной фольги, дифракцию рентгеновских лучей проводили сразу после очистки подложки. На рентгеновской дифрактометрии был набор пиков Брэгга, которые можно было легко проиндексировать по структуре fcc металлической меди (Fmm, Å, JCPDF no.85-1326) (рисунок 1). Профили дифракции медной фольги A, C и B, D демонстрируют очень отличительные особенности. На рисунке 1 есть два пика на медной фольге A и C при 2 θ = 50,50 ° и 2 θ = 43,36 °, соответствующих плоскости (200) и плоскости (111) медных структур. По сравнению с рентгенограммой медной фольги A и C, появился только пик при 2 θ = 50,50 °, соответствующий отражению (200) кристаллов в образце B и D.Такая особенность указывает на то, что кристаллы меди в образцах B и D преимущественно ориентированы так, что их оси a перпендикулярны поверхности подложки. Средний размер зерна можно рассчитать с помощью уравнения Шеррера [22]: где λ - длина волны рентгеновского излучения, θ - угол дифракции Брэгга и - полная ширина на полувысоте (FWHM) пика, соответствующего θ . При расчете с использованием пика, соответствующего плоскости (200) меди, результирующий размер зерна в медной фольге A составляет около 72.2 нм, в медной фольге B составляет примерно 35,6 нм, в медной фольге C составляет примерно 64,5 нм, а в медной фольге D составляет примерно 34,3 нм. Размер зерен в медной фольге A и C примерно в два раза больше, чем в медных B и D. Таким образом, количество зерен в медной фольге B и D больше, чем в меди A и C. Свойства медной фольги A, B, C и D приведены в таблице 1.
| ||||||||||||||||||||||||
3.2. Влияние температуры окисления
На рис. 2 показаны СЭМ-изображения морфологии поверхности после нагревания медной фольги A, B, C и D при 300 ° C в течение 2 часов в потоке воздуха 0.5 л / мин. Соответственно. Как видно, оксидные зерна наблюдаются на четырех подложках. Зерна оксида на меди A и C менее компактны, чем другие зерна на меди B и D. Измеренные размеры зерна оксида на меди A и C составляют около 250 и 300 нм. Зерна на медной фольге B и D более плотные, размером около 160 и 170 нм, без нанопроволок на поверхности образца. Зерна оксида становятся больше при повышении температуры. Зерна оксида, образованные на медной фольге B и D (меньший размер зерна), намного меньше, чем зерна, образованные на медной фольге A и C (больший размер зерна) на ранней стадии окисления.Это связано с большим количеством центров зародышеобразования на меньшем размере зерна медной фольги. Из морфологии образцов, выращенных при 400 ° C (рис. 3), видно, что нанопроволоки образовывались при этой температуре. На медной фольге B и D образуются более плотные, более однородные и более длинные нанопроволоки по сравнению с медной фольгой A и C. При повышении температуры до 500 ° C на медных B и D формируется большое количество нанопроволок (рисунки 4 (B) и 4 (D)). Видно, что длинные и однородные нанопроволоки образуются по всей поверхности, а нанопроволоки в основном расположены вертикально вдоль поверхности подложки.Средние диаметры нанопроволок на медной фольге B и D составляют около 80 и 100 нм, а средняя длина нанопроволок на тех же подложках составляет около 7 и 8 мкм и м соответственно. Тем не менее, нанопроволоки CuO большой площади и высокой плотности также могут расти из медных подложек A и C в потоке воздушного газа, как показано на рисунках 4 (A) и 4 (C). Свежеприготовленные нанопроволоки на медной фольге A и C не были хорошо выровнены по вертикали вдоль поверхности подложки с длинами примерно 4 и 5 мкм, м и диаметром примерно 50 и 62 нм.Желательно выращивать однородные и вертикально ориентированные нанопроволоки CuO большой площади вдоль поверхности медной подложки для применения в автоэмиссионных эмиттерах [23] и реализации наноразмерных энергетических материалов на основе CuO / Al [24]. При 600 ° C на медной фольге B и D формируются однородные нанопроволоки высокой плотности, как показано на рисунках 5 (B) и 5 (D). Однако эти нанопроволоки длиннее, чем нанопроволоки на медной фольге A и C, с длиной в диапазоне от 5 до 15 мкм, м и диаметром около 180 нм, как показано на рисунке 5.Большое количество нанопроволок низкой плотности наблюдалось на медной фольге A и C, приготовленной при 600 ° C, длиной от 3 до 6 мкм, м и диаметром от 100 до 400 нм. Можно сделать вывод, что размер зерна и ориентация кристаллов медной фольги оказывают большое влияние на рост нанопроволок. Меньший размер зерна у медной фольги с ориентацией (200) способствует росту нанопроволок.




3.3.Характеристики поперечных сечений образцов нанопроволоки CuO
На рис. 6 показаны СЭМ-изображения поперечных сечений окисленной медной фольги A и B при 500 ° C в течение 2 часов. Чтобы измерить толщину оксидного слоя, оксидную чешуйку осторожно удалили с медной подложки. Когда медная фольга окисляется, вначале основным продуктом является Cu 2 O, и ожидается, что CuO образуется на второй стадии окисления Cu 2 O [15, 27]. В этом случае Cu 2 O служит прекурсором CuO.Самый внешний слой всегда состоит из CuO, если оксид состоит как из Cu 2 O, так и из CuO. В этом двухслойном оксиде фракционная толщина внешнего слоя в основном зависит от температуры отжига. На рисунке 6 (A) оксидный слой разделен на нижний слой из Cu 2 O и самый внешний слой из CuO [28]. С помощью измерения EDX было обнаружено, что слой CuO составляет около 0,9 мкм толщиной м, а слой Cu 2 O составляет около 4,2 мкм мкм для медной фольги A. Для медной фольги B самый внешний слой CuO толще, чем у фольги A. что около 1.8 мкм толщиной м (рисунок 6 (Б)). Нижний слой Cu 2 O явно толще (около 5,8 мкм мкм). Общая толщина слоя на медной подложке B составляет около 7,6 мкм мкм, что больше, чем у медной фольги A (около 5,1 мкм мкм). Более толстый оксидный слой на медной фольге B обусловлен более высокой скоростью окисления. В принципе, ионы меди и ионы кислорода могут диффундировать по чешуе намного быстрее по границам зерен, чем через объем.Высокая скорость окисления медной фольги B может быть связана с меньшим размером зерна, что приводит к более быстрым общим темпам роста окалины.

3.4. Исследование нанопроволок CuO с помощью ПЭМ
Мы дополнительно охарактеризовали размер, структуру и кристалл этих нанопроволок с помощью ПЭМ и дифракции на выбранных площадях (SAD). Отобранный образец готовили при 500 ° C в течение 2 ч. На рисунках 7 и 8 представлены дифракционные картины ПЭМ отдельной нанопроволоки медной фольги A и B, окисленной при 500 ° C в течение 2 часов.На Рисунке 8 (A) видно, что нанопроволока из медной фольги B имеет проволочную форму с очень гладкой поверхностью с диаметром около 70 нм. По сравнению с нанопроволокой фольги B поверхность нанопроволоки медной фольги A имеет шероховатость и диаметр около 45 нм (рис. 7 (A)). Для медной фольги B наблюдается больший диаметр нанопроволоки (на рисунке 8 (A)) по сравнению с медной фольгой A (рисунок 7 (A)), что может быть связано с большим количеством границ зерен медной фольги B. Рисунок 7 ( B) показывает картину дифракции ПЭМ отдельной нанопроволоки от медной фольги A.Обычно это наблюдается, когда электронный луч фокусируется на отдельную нанопроволоку вдоль направления. Двойная дифракция возникает из-за двойной плоскости внутри нанопроволоки. На рисунке 8 (B) также показана дифракционная картина ПЭМ отдельной нанопроволоки из медной фольги B, полученной при 500 ° C. Точно так же двойная дифракция вызывается двойниковой плоскостью внутри нанопроволоки, каждое установленное дифракционное пятно представляет собой монокристалл и соответствует моноклинной структуре CuO с постоянными решетки, нм, нм, нм и.


4. Обсуждение
Образование нанопроволок происходит, когда в результате окисления меди постепенно образуются два слоя оксидов меди [15, 26–28]. Мы исследуем наши результаты на основе механизмов роста нанопроволоки, описанных в литературе. Go ņ alves et al. предположили, что рост нанопроволок CuO происходит за счет зернограничной диффузии ионов меди через слой Cu 2 O и ионов кислорода через крайний слой CuO [25].Xu et al. также предположили, что рост нанопроволок происходит за счет диффузии по границам зерен [26]. Эта идея имеет сходство с моделью, предложенной недавно для формирования нанопроволок Fe 2 O 3 [29]. Однако Park et al. и Shao et al. Сообщается, что механизм роста нанопроволок в этом случае связан с релаксацией сжимающих напряжений [27, 28]. Здесь мы считаем, что рост нанопроволоки происходит для уменьшения напряжения, возникающего во время окисления меди в процессе диффузии по границам зерен [20].Теперь мы обсудим, как предложенная модель может быть объяснена полученными нами результатами. Длинные, высокоплотные и ориентированные нанопроволоки оксида меди, наблюдаемые на рисунках 3, 4, 5 (B) и 5 (D), можно отнести к границам зерен и направлению кристаллов с эффективной релаксацией сжимающего напряжения. Хорошо известно, что начальная скорость окисления металла при промежуточных температурах (300–600 ° C для меди) слишком высока, чтобы приписывать ее только решеточной диффузии различных ионных частиц в его оксидной пленке [30].В окислении меди при низких температурах преобладают границы зерен. Меньший размер зерен и более высокая энергия границ зерен могут играть важную роль в увеличении эффективного коэффициента диффузии ионов меди и кислорода в кристаллитах меньшего размера при промежуточных температурах в результате диффузии по границам зерен [31]. Окисление фольги Cu до Cu 2 O и Cu 2 O до CuO приводит к сжимающему напряжению на границе раздела из-за изменения объема и структуры.Напряжение сжатия вызывает внешнюю диффузию катионов меди вдоль границ зерен, что приводит к росту нанопроволоки CuO на зернах CuO [27]. Следовательно, на рисунках 3, 4, 5 (B) и 5 (D) наблюдается высокая плотность нанопроволок по сравнению с рисунками 3, 4, 5 (A) и 5 (C), поскольку увеличивается количество границ зерен. релаксация сжимающих напряжений на границе слоев CuO и Cu 2 O. Ориентированное направление способствует диффузии катионов меди по границам зерен в медной пленке.Это может повлиять на поверхность нанопроволоки. Изображения ПЭМ, представленные на рисунке 8, показывают большой диаметр нанопроволоки и нанопроволоки с гладкой поверхностью, сформированных на медной фольге B. Это также объясняется релаксацией сжимающего напряжения за счет эффективной диффузии границ зерен. В зависимости от температуры окисления диффузия атомов или ионов может происходить внутри решетки через границы зерен в оксидном слое. В результате плотность нанопроволоки уменьшается с увеличением температуры, как видно на последовательности изображений SEM на Рисунке 5.В нашем эксперименте зерна оксида становятся больше при повышении температуры. Хотя мы пытались поднять температуру нагрева до 800 ° C, наблюдались большие зерна оксида, но на поверхности подложки не появлялись нанопроволоки. Когда температура выше 800 ° C, в окислении меди преобладает решеточная диффузия ионов меди; влияние диффузии по границам зерен, наконец, станет небольшим по сравнению с диффузией по решетке. Этим объясняется отсутствие нанопроволок для окисления при 800 ° C.Относительная важность переноса границ зерен через масштаб зависит от размера зерна оксида и температуры и имеет тенденцию становиться незначительной при достаточно высоких температурах [32]. При нагревании медной фольги с меньшим размером зерен с ориентацией (200) в потоке воздуха и газа большое количество границ зерен способствует релаксации сжимающего напряжения, что приводит к росту нанопроволок с высокой плотностью и гладкой поверхностью.
5. Заключение
Высокоплотные, гладкие и ориентированные нанопроволоки оксида меди были синтезированы путем нагрева медных фольг с меньшим размером зерен и (200) ориентированными в потоке воздуха.С другой стороны, однородные, гладкие и ориентированные нанопроволоки не могут быть получены путем нагрева медной фольги с большим размером зерна и двумя ориентациями кристаллов. Разница объясняется более быстрой релаксацией сжимающих напряжений за счет наружной диффузии ионов меди и внутренней диффузии кислорода по границам зерен (как в металле, так и в слое для меньшего размера зерен медной подложки). Малый размер зерен медной фольги B и C способствует росту нанопроволок из-за большего количества границ зерен.Выровненные нанопроволоки оксида меди и гладкой поверхности могут быть получены путем нагревания медной фольги с ориентацией (200).
.Свойства алюминия
Физические свойства алюминия
основной Физические свойства алюминия и алюминиевого сплава, которые пригодны для использования:
Эти свойства алюминия представлены в таблицах ниже [1]. Их можно рассматривать только как основу для сравнения сплавов и их состояний и не следует использовать для инженерных расчетов. Это не гарантированные значения, поскольку в большинстве случаев это средние значения для продуктов разных размеров, форм и способов изготовления.Следовательно, они могут не точно соответствовать продуктам всех размеров и форм.
Номинальные значения популярных плотностей алюминиевых сплавов представлены в отожженном состоянии (О). Различия в плотности из-за того, что сплавы, содержащие различные легирующие элементы в разном количестве: кремний и магний легче алюминия (2,33 и 1,74 г / см 3 ), а железо, марганец, медь и цинк - тверже (7,87; 7,40; 8,96 и 7,13 г / см 3 ).
Влияние глинозема и физических свойств, в частности его плотности, на структурные характеристики алюминиевых сплавов см.Вот.
Алюминий как химический элемент
- Алюминий Это третий по распространенности (после кислорода и кремния) среди примерно 90 химических элементов, которые содержатся в земной коре.
- Среди металлических элементов - он первый.
- Этот металл обладает множеством полезных свойств, физических, механических, технологических, благодаря которым он широко используется во всех сферах жизнедеятельности человека.
- Алюминий - ковкий металл, имеющий серебристо-белый цвет, легко обрабатывается большинством методов обработки металлов давлением: прокаткой, волочением, экструзией (прессованием), ковкой.
- Его плотность - удельный вес - составляет около 2,70 граммов на кубический сантиметр.
- Чистый алюминий плавится при температуре 660 градусов по Цельсию.
- Алюминий имеет относительно высокую теплопроводность и электропроводность.
- В присутствии кислорода всегда покрывается тонкой невидимой оксидной пленкой. Эта пленка практически непроницаема и обладает относительно высокими защитными свойствами. Поэтому алюминий обычно показывает стабильность и долгий срок службы в нормальных атмосферных условиях.
Сочетание свойств алюминия и его сплавов
Алюминий и его сплавы обладают уникальным сочетанием физических и других свойств. Он изготовлен из алюминия с использованием одного из самых универсальных, экономичных и привлекательных строительных и потребительских материалов. Алюминий используется в очень широком диапазоне - от мягкой, очень пластиковой упаковочной пленки до самых сложных космических проектов. Алюминий считается вторым после стали среди множества конструкционных материалов.
низкая плотность
Алюминий - одно из самых легких промышленных сооружений. Плотность алюминия примерно в три раза ниже, чем у стали или меди. Это физическое свойство обеспечивает высокую удельную прочность - прочность на единицу веса.
 Рисунок 1.1 - Удельный вес алюминия по сравнению с другими металлами [3]
Рисунок 1.1 - Удельный вес алюминия по сравнению с другими металлами [3]
 Рисунок 1.2 - Влияние легирующих элементов
Рисунок 1.2 - Влияние легирующих элементов
на прочностные свойства, твердость, хрупкость и пластичность
[3]

Рисунок 1 - Прочность алюминия на единицу плотности в сравнении с различными металлами и сплавами [3]

Рисунок 2 - Кривые растяжения алюминия в сравнении с различными металлами и сплавами [3]
Таким образом, алюминиевые сплавы широко используются в транспортном машиностроении для увеличения грузоподъемности автомобилей и экономии топлива.
- паром-катамарана,
- нефтяных танкеров и
- самолетов -
Вот лучшие примеры использования алюминия на транспорте.

Рисунок 3 - плотность алюминия в зависимости от чистоты и температуры [2]
коррозионная стойкость
Алюминий обладает высокой коррозионной стойкостью за счет тонкого слоя оксида алюминия на его поверхности. Эта оксидная пленка образуется мгновенно, как только свежая поверхность алюминия входит в контакт с воздухом (рисунок 4).Во многих случаях это свойство позволяет использовать алюминий без специальной обработки поверхности. Если необходимо дополнительное защитное или декоративное покрытие, применяется анодирование или окраска поверхности.

Рисунок 4
а - естественное оксидное покрытие на сверхчистом алюминии;
b - алюминий чистоты коррозии 99,5% с естественным оксидным покрытием
коорозионно в агрессивных средах [2]

Рисунок 5.1 - Влияние легирующих элементов на коррозионную стойкость и усталостную прочность [3]

Рисунок 5.2 - точечная коррозия (точечная коррозия) алюминиевых листов
из сплава 3103 в различных агрессивных средах [3]
Прочность
Механические свойства чистого алюминия довольно низкие (рисунок 6). Однако эти механические свойства могут сильно вырасти, если в легирующие элементы добавлен алюминий и, кроме того, он подвергнется термическому (рисунок 6) или деформационному (рисунок 7) упрочнению.
Типичные легирующие элементы включают:
- марганец, Кремний
- ,
- медь,
- магний,
- и цинк.
Рисунок 6 - Влияние чистоты алюминия на его прочность и твердость [2]

Рисунок 7 - Механические свойства деформируемых высокочистых
алюминиево-медных сплавов в различных состояниях [2]
(О - отожженные, W - сразу после отпуска, Т4 - естественно состаренные, Т6 - искусственно состаренные)
 Рисунок 8 - Механические свойства алюминия 99,50%
Рисунок 8 - Механические свойства алюминия 99,50%
в зависимости от степени холодной деформации [2]

Рисунок 2 - Влияние легирующих элементов на плотность и модуль Юнга [3]
Стойкость при низких температурах
Известно, что сталь становится хрупкой при низких температурах.Кроме того, алюминий при низких температурах увеличивает свою прочность и сохраняет высокую вязкость. Именно это физическое свойство позволило использовать его в космических аппаратах, в условиях работы в холодном пространстве.

Рисунок 9 - Изменение механических свойств алюминиевого сплава 6061
при понижении температуры
Теплопроводность
Алюминий проводит тепло в три раза быстрее, чем сталь. Это физическое свойство очень важно в теплообменниках для нагрева или охлаждения рабочей среды.здесь - широкое применение алюминия и его сплавов в посуде, кондиционерах, примышленных и автомобильных теплообменниках.

Рисунок 10 - Теплопроводность алюминия по сравнению с другими металлами [3]
отражательная способность
Алюминий - отличный отражатель лучистой энергии во всем диапазоне длин волн. Это физическое свойство позволяет использовать его в устройствах, которые работают против ультрафиолетового спектра через видимый спектр, инфракрасного спектра и тепловых волн, а также таких электромагнитных волн, как радиоволны и радиолокационные волны [1].
Алюминий обладает способностью отражать более 80% световых волн, что обеспечивает широкое применение в осветительных приборах (рисунок 11). Благодаря своим физическим свойствам используется в теплоизоляционных материалах. например, алюминиевая кровля отражает большую часть солнечного излучения, что обеспечивает прохладу в помещении летом и, в то же время, сохраняет тепло в помещении зимой.

Рисунок 11 - Отражающие свойства алюминия [2]

Рисунок 12 - Эмиссионные и отражающие свойства алюминия с различной обработкой поверхности [3]

Рисунок 13 - Сравнение отражающих свойств различных металлов [3]
электрические свойства
- Алюминий - один из двух доступных металлов, которые обладают достаточно высокой электропроводностью, чтобы применять их в качестве электрических проводников.
- Электропроводность «электрического» алюминия марки 1350 составляет около 62% от международного стандарта IACS - электропроводность отожженной меди.
- Однако удельный вес алюминия составляет лишь треть от удельного веса меди. Это означает, что он тратит вдвое больше электроэнергии, чем медь того же веса. Это физическое свойство обеспечивает алюминий, широко используемый в высоковольтных линиях электропередачи (ЛЭП), трансформаторах, электрических автобусах и электрических лампах.

Рисунок 14 - Электрические свойства алюминия [3]
Магнитные свойства
Алюминий не намагничивается в электромагнитных полях. Это делает его полезным для защиты оборудования от воздействия электромагнитных полей. Еще одно применение этой функции - компьютерные диски и параболическая антенна.

Рисунок 15 - Намагниченный алюминиевый сплав AlCu [3]
токсичные свойства
Это свойство алюминия - отсутствие токсичности - было обнаружено в начале его промышленного освоения.Именно это свойство алюминия позволило использовать его для изготовления кухонной утвари и техники, не оказывая вредного воздействия на человеческий организм. Алюминий с его гладкой поверхностью легко чистится, при готовке важно обеспечить высокую гигиену. Алюминиевая фольга и контейнеры широко и безопасно используются при упаковке прямого контакта с пищевыми продуктами.
звукоизоляционные свойства
Это свойство позволяет использовать алюминий при выполнении акустических потолков.
Способность поглощать энергию удара
Алюминий имеет модуль упругости в три раза меньше, чем сталь.Это физическое свойство делает его большим преимуществом для изготовления автомобильных бамперов и других средств защиты автомобилей.

Рисунок 16 - Автомобильные алюминиевые профили
для поглощения энергии удара при аварии
огнезащитные свойства
Алюминиевые детали не образуют искр при ударах друг о друга, а также о других цветных металлах. Это физическое свойство используется при повышенных мерах пожарной безопасности конструкции, например, на морских нефтяных вышках.
В то же время при повышении температуры выше 100 градусов Цельсия прочность алюминиевых сплавов значительно снижается (рисунок 17).

Рисунок 17 - Прочность на растяжение алюминиевого сплава 2014-T6
при различных температурах испытаний [3]
Технологические свойства
Легкость, с которой алюминию можно придать любую форму - технологичность, это одно из важнейших его преимуществ. Очень часто он может успешно конкурировать с более дешевыми материалами, с которыми намного сложнее обращаться:
- Этот металл можно отливать любым способом, который известен металлургам, литейному производству.
- Его можно свернуть до толщины фольги или более тонких листов бумаги.
- Алюминиевые пластины можно штамповать, растягивать, устанавливать и формовать всеми известными методами обработки металлов давлением.
- Алюминий поддается любой ковке Алюминиевый провод
- , вытянутый из круглого стержня. Из него можно вплетать электрические кабели любого типа и размера.
- Нет никаких ограничений по форме профилей, в которых он изготовлен из данного металла методом экструзии (прессования).

Рисунок 18.1 - литье алюминия в песчаные формы
Рисунок 18.2 - Непрерывная разливка-прокатка алюминиевой полосы [5]

Рисунок 18.3 - Десантная операция при изготовлении алюминиевых банок [4]
 Рисунок 18.4 - операция ковки алюминия
Рисунок 18.4 - операция ковки алюминия
Рисунок 18.5 - Алюминий холодного волочения

Рисунок 18.6 - Прессование (экструзия) алюминия
Источники:
- Алюминий и алюминиевые сплавы.- ASM International, 1993.
- А. Свердлин Свойства чистого алюминия // Справочник по алюминию, Vol. 1 / под ред. G.E. Тоттен, Д.С. Маккензи, 2003
- ТАЛАТ 1501
- ТАЛАТ 3710
.
Свойства материала
| Существительное | Прилагательное | Примеры материалов | |
| вес | a легкий материал a тяжелый материал | алюминий, свинец магний, медь | |
| гибкость жесткость | a гибкий материал a жесткий материал | тонких листов металла, пластикового камня, чугуна | |
| горючесть | горючий материал | резина, пластик | |
| пожар сопротивление | негорючий материал | глина, стекло | |
| прозрачность | a прозрачный материал | вода, некоторые пластмассы | |
| непрозрачность | и непрозрачный материал | Камень | |
| коррозионная стойкость | коррозионностойкий материал материал не устойчив к коррозии | цинк, хром, оловянный чугун | |
| проводимость | хороший кондуктор г. нагреть плохой провод из высокая температура | каучук серебристый | |
| эластичность | и эластичный материал | нейлон | |
| пластичность | a пластик материал | медь, алюминий | |
| мягкость | a мягкий материал | резина, нейлон | |
| твердость - | a твердый материал | чугун |
И.Взгляните на эти примеры:
Человек может легко поднять большой рулон
стекловата, но не бетонная балка.
Стекловата - легкая , но бетон -
Человек может гнуть резиновую плитку, но не бетонную плитку.
Резина гибкая , но бетон жесткий.
Дерево может гореть, но бетон не гореть.
Древесина горючая, , бетон негорючая.
Водяной пар может проходить через камень, но не через битум.
Stone имеет проницаемость , , но битум непроницаем.
Вы можете видеть сквозь стекло, но не сквозь дерево.
Стекло прозрачное , а дерево непрозрачное.
Нержавеющая сталь может противостоять коррозии, а мягкая сталь - нет.
Нержавеющая сталь устойчива к коррозии , но низкоуглеродистая сталь не устойчива к коррозии.
Тепло легко передается через медь, но не через дерево.
Медь является хорошим проводником тепла , а древесина плохо проводит тепло.
Резину можно растянуть или сжать, а затем она вернется к своей первоначальной форме, а глина - нет.
Резина - это эластичная , а глина - это пластмасса.
Битум можно легко поцарапать или поцарапать, но стекло - нет. Битумен мягкий , но стекло твердое.
Посмотрите на эти схемы. Сравните буквы A-H на схемах с предложениями ниже:

Теперь дополните эти предложения свойствами:
a) Полиэтиленовая мембрана предотвращает проникновение влаги в бетонный пол.Это означает, что полиэтилен _______.
b) Т-образный алюминиевый профиль может противостоять химическому воздействию, т.е. е. алюминий ..
c) Каменный блок нельзя поднять без использования крана. Это означает, что камень ___________.
г) Крыша из гофрированного железа не может предотвратить нагревание дома солнцем, т.е. е. железо есть.
e) Стекловата может помочь сохранить тепло в доме зимой и прохладу летом, т.е.е. стекловата
f) Керамическая плитка на полу не может быть легко поцарапана людьми, идущими по ней. Это означает, что керамическая плитка ___
г) Асбестовая пленка может использоваться для противопожарной защиты дверей. Другими словами, асбест - это ________.
h) Черные тканевые жалюзи могут использоваться для защиты помещения от света, т. Е. Ткань ________.
II.Составьте предложения о четырех других свойствах материалов из этой таблицы:
| Стали Камень Стакан шерсть Кирпич | имеет свойство | хорошая звукоизоляция, хорошая теплоизоляция. высокая прочность на сжатие, высокая прочность на разрыв. | |
| Это означает | выдерживает высокие сжимающие силы, он может противостоять высоким растягивающим усилиям, он плохо передает тепло, он не передает звук легко. |
III. Ответьте на следующие вопросы:

Почему стекло используется для оконных стекол?
Потому что стекло такое.
Почему стекловата используется для сохранения тепла в баках с горячей водой?
Потому что стекловата имеет свойство
.....
Почему некоторые стали покрыты тонким слоем цинка ?
Потому что цинк есть...
Почему некоторые противопожарные двери
покрыты листами асбеста?
Потому что асбест ...
Почему некоторые металлические листы
имеют гофрированную форму?
Потому что гофрированная форма
делает лист_
Почему используется бетон для.
колонн строительной конструкции?
Потому что ..
Урок 10
Часть I
Дата: 24 декабря 2015 г .; просмотр: 2502
.
Изготовление тонких пленок нанотрубок и их газочувствительные свойства
Рассмотрены процесс изготовления и механизм роста нанотрубок титана / диоксида титана, полученных методом анодирования, и их применения в областях сенсибилизированных красителями солнечных элементов, фотокатализаторов, электрохромных устройств, газа. представлены сенсоры и биоматериалы. Анодирование тонких пленок Ti на различных подложках и процесс роста анодного оксида титана описаны с помощью кривых зависимости тока от времени.Особое внимание уделяется влиянию исходной гладкости пленки на получаемую морфологию нанопористых частиц. «Модель толщины порогового барьерного слоя» используется для обсуждения механизма роста. В качестве примера для газового зондирования были подготовлены анодированные высокоупорядоченные массивы нанотрубок и нанопористые тонкие пленки, которые демонстрируют пористую поверхность со средним диаметром 25 нм и межпоровым расстоянием 40 нм. На основе таких массивов нанотрубок и тонких нанопористых пленок были изготовлены газовые сенсоры и исследованы их чувствительные свойства.Превосходные газоочувствительные свойства были получены для сенсоров, изготовленных из этих высокоупорядоченных массивов нанотрубок, которые демонстрируют стабильный отклик даже при низкой рабочей температуре, составляющей 0,15 мм. Основываясь на наших экспериментальных результатах, механизм «H-индуцированной десорбции» был использован для объяснения механизма восприятия газообразного водорода.
1. Введение
Нанопористые структуры имеют большое значение для множества наноструктурированных, потому что они не только обладают общими свойствами, которые широко используются в наноматериалах, такими как поверхностный эффект, размерный эффект и улучшенные химические и оптические свойства, но также могут быть используются в качестве «наношаблонов» для изготовления других наноструктур, таких как наноточки, нанопроволоки и нанотрубки, что еще больше расширяет возможности их применения.В последние годы, в связи с активизацией исследований в области разработки наноматериалов, свойства множества новых функциональных устройств были в значительной степени исследованы на основе уникальных оптических, механических, химических и электрических свойств наноматериалов.
Несомненно, что анодный
.